编者按:IMpassion 031研究是首个阿替利珠单抗在早期TNBC中显示获益的Ⅲ期临床试验,2020年ESMO大会上IMpassion 031研究结果问世,结果提示阿替利珠单抗虽显著提高了TNBC患者pCR率,但与PD-L1表达无关。2021年AACR大会上,针对达pCR患者肿瘤免疫生物标记物的探索性分析入选了大会壁报。《肿瘤瞭望》特邀大连医科大学附属第二医院王嘉教授对其进行了点评。
接受阿替利珠单抗+化疗达到病理完全缓解(pCR)的早期三阴性乳腺癌(eTNBC)患者肿瘤免疫生物标记物的评估——来自IMpassion031研究的探索性分析
【背景】免疫治疗的出现冲击着难治性三阴性乳腺癌(TNBC)的治疗格局。免疫调节点抑制剂(阿替利珠单抗和帕博利珠单抗)提高了晚期TNBC患者的无疾病进展生存时间(PFS),尤其对于PD-L1阳性人群疗效显著,例如在IMpassion 031研究中试验组与对照组相比3年的总体生存(OS)达到25.4个月对17.9个月的获益。而针对早期TNBC患者,从理论上来讲,较高的突变负荷、肿瘤相关性免疫细胞富集、未曾产生继发耐药克隆等特点使得早期TNBC的疗效似乎要优于晚期TNBC;从临床需求上讲,对于一些伴随高危因素的亚群,显然现有的蒽环联合紫杉,甚至强化卡培他滨的新辅助或辅助治疗是远远不足以覆盖未来十年甚至五年的复发风险。从循证医学数据上看,类似KEYNOTE 522、IMpassion 031等研究中,我们看到了增加免疫调节点抑制剂组可以显著提高pCR率,并且在陆续公布的长期生存数据以及患者生存报告中也看到了生存的改善和理想的安全性。
制约免疫治疗临床应用于早期TNBC的瓶颈问题是:生物标志物尚不明确。例如在IMpassion 031研究中免疫调节点抑制剂加入带来的pCR率提升并不与PD-L1表达相关。显然,早期和晚期TNBC者的免疫微环境截然不同,无法将晚期的生物标志物照搬照套于早期患者中。换句话讲,并非所有早期TNBC者都适用于免疫治疗,同时免疫治疗可能会带来严重的副反应及高昂的花费。无论对于早期还是晚期TNBC,如何找到适合的生物标志物正是人类驾驭免疫治疗这匹野马的关键所在。
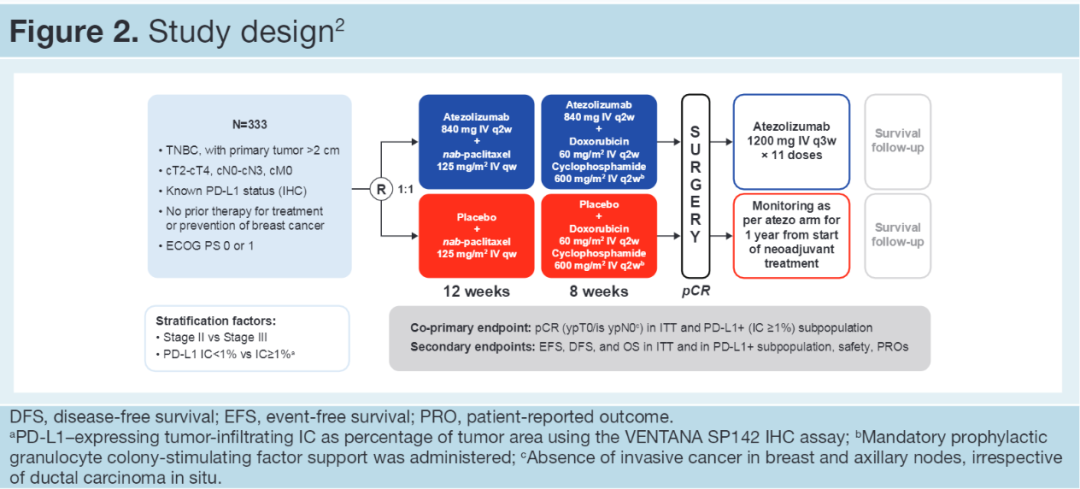
IMpassion 031(NCT03197935)是一项全球多中心、随机、双盲的Ⅲ期临床研究。旨在评估阿替利珠单抗联合化疗在早期TNBC新辅助治疗中的疗效和安全性。患者入组条件为:1.年龄≥18岁;2.入组前未接受治疗;3.Ⅱ-Ⅲ期(cT2-T4d和cN0-N3c);4.浸润性eTNBC(M0)。该研究共入组了333名术前患者并按1:1随机分配至:接受840mg阿替利珠单抗或安慰剂每2周+白蛋白结合型紫杉醇125mg/m2每周,共12周续贯840mg或安慰剂每两周+多柔比星60 mg/m2+环磷酰胺600mg/m2每2周,共8周。
2021年AACR公布了IMpassion 031的探索性分析,即接受阿替利珠单抗+化疗达到病理完全缓解(pCR)患者肿瘤免疫生物标记物的评估。此次公布的探索性分析研究中,评估了基线全部333名患者和治疗时27名患者收集的样本中免疫细胞(IC)和肿瘤细胞(TC)上PD-L1表达(VENTANA SP142),PD-L1≥1%视为阳性、间质和瘤内肿瘤浸润淋巴细胞(sTILs, iTILs)水平以及三级淋巴结构(TLS)的存在。并对动态变化与pCR的相关性进行了评价(见Figure2 Study design)。
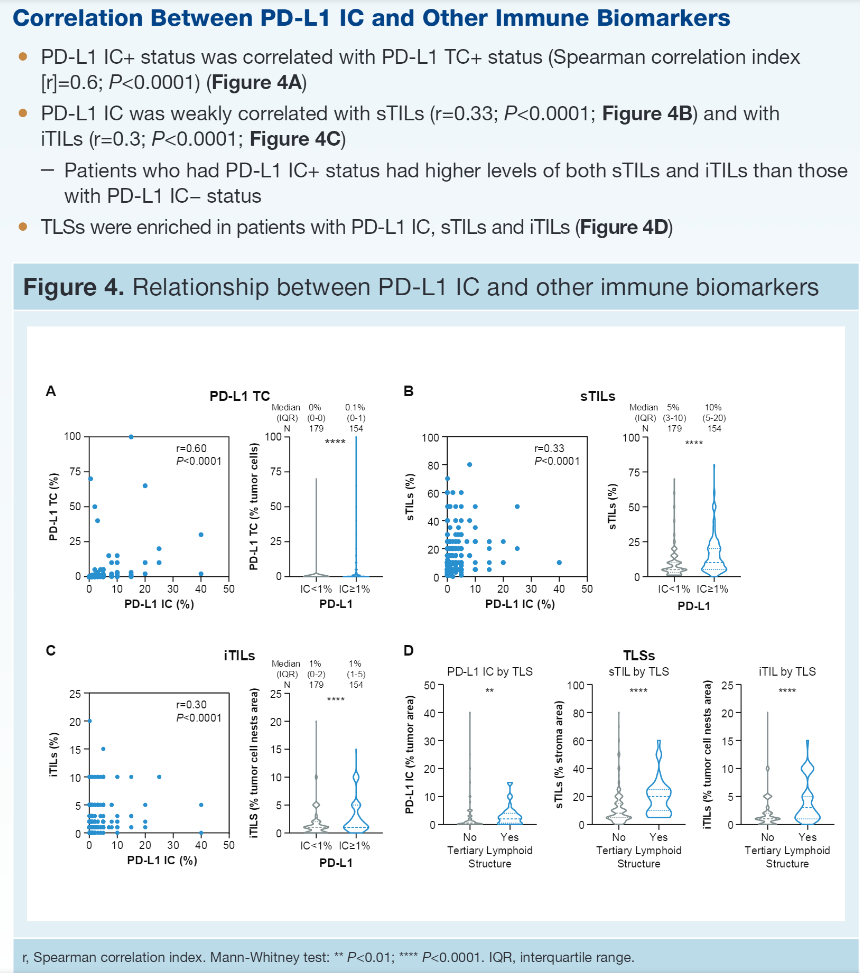
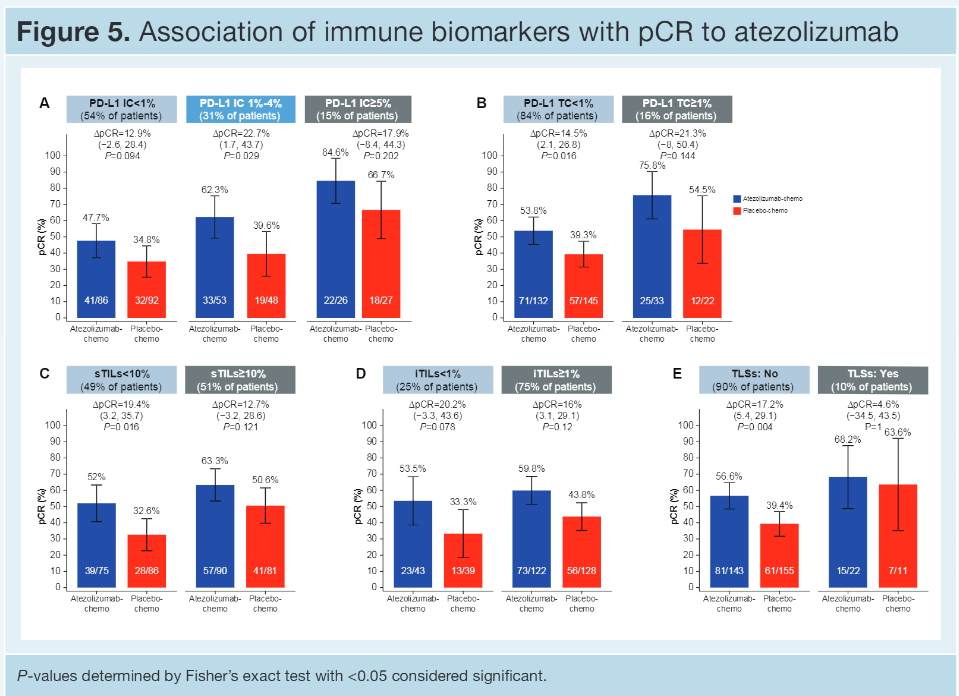
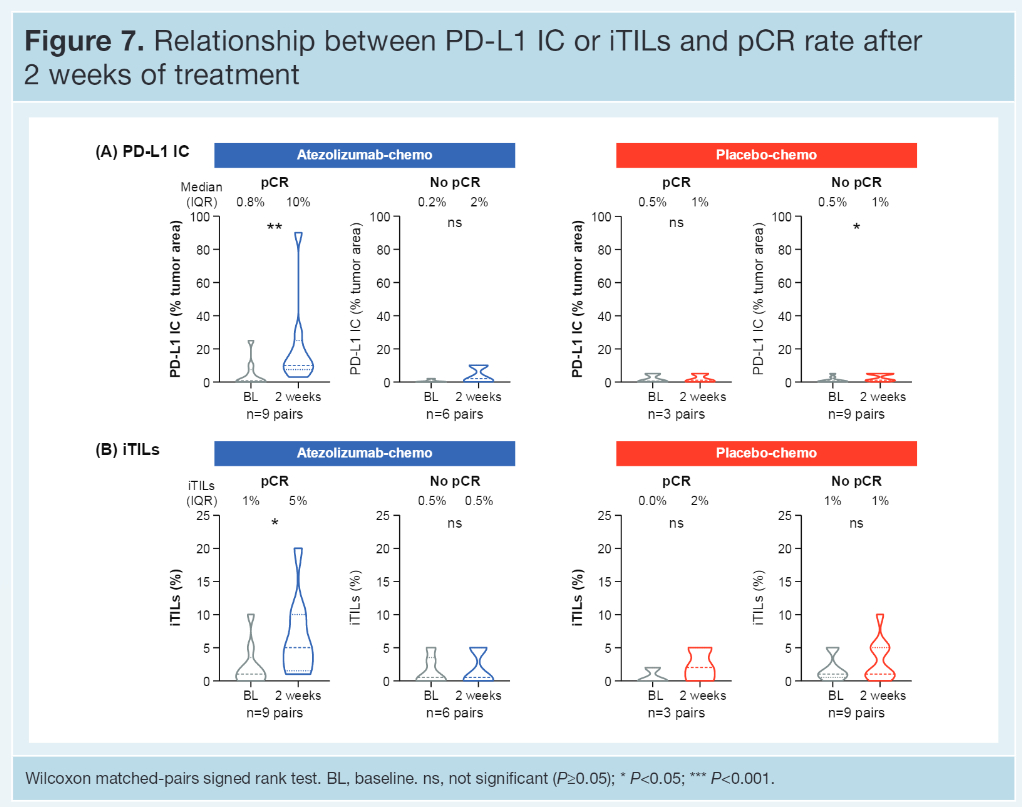
【结果】 PD-L1 IC、PD-L1 TC、sTIL和iTIL水平在治疗组之间是平衡的。46%患者为PD-L1 IC+(IC≥1%),16%患者为PD-L1 TC+(TC≥1%);后者大部分也是IC+。PD-L1 IC与sTILs (r=0.33)或iTILs(r=0.30)相关性较弱。无论哪个治疗组,pCR率均随着PD-L1 IC界值的升高而升高,且A组(阿替利珠组)更高 [A组:PD-L1 IC<1%:48%;IC≥1%和<5%:62%;IC≥5%:85%;P组(对照组)分别为 35%、40%和67%]。更耐人寻味的是,对比TC-者,在PD-L1 TC+患者中观察到了数字上更高的有利于A 组对P组的pCR差异(PD-L1 TC+:76% vs 55%;PD-L1 TC-:54% vs 39%)。在A组中,升高的sTILs、iTILs或TLS均与增加的pCR率无关,而在P组中上述生物标志物与改善的pCR率有关。治疗中(OT)活检的评估表明,加入阿替利珠(A)到白蛋白紫杉醇(nP)可提高PD-L1 IC、TC和iTILs,但不能提高sTILs,而对照组(安慰剂加nP)可轻度提高PD-L1 IC,但不能提高其他检测的生物标志物。治疗开始2周后PD-L1 IC和iTILs的增加与pCR有关。
【结论】在IMpassion 031研究对照组中,几个肿瘤免疫生物标志物相互关联,并与升高的pCR率相关;但在阿替利珠治疗组中只有PD-L1在IC或TC上的表达与pCR率数值增加有关。初步分析显示,免疫治疗联合化疗促进淋巴细胞与肿瘤细胞的密切接触。有必要进一步评估免疫治疗组的肿瘤免疫微环境。

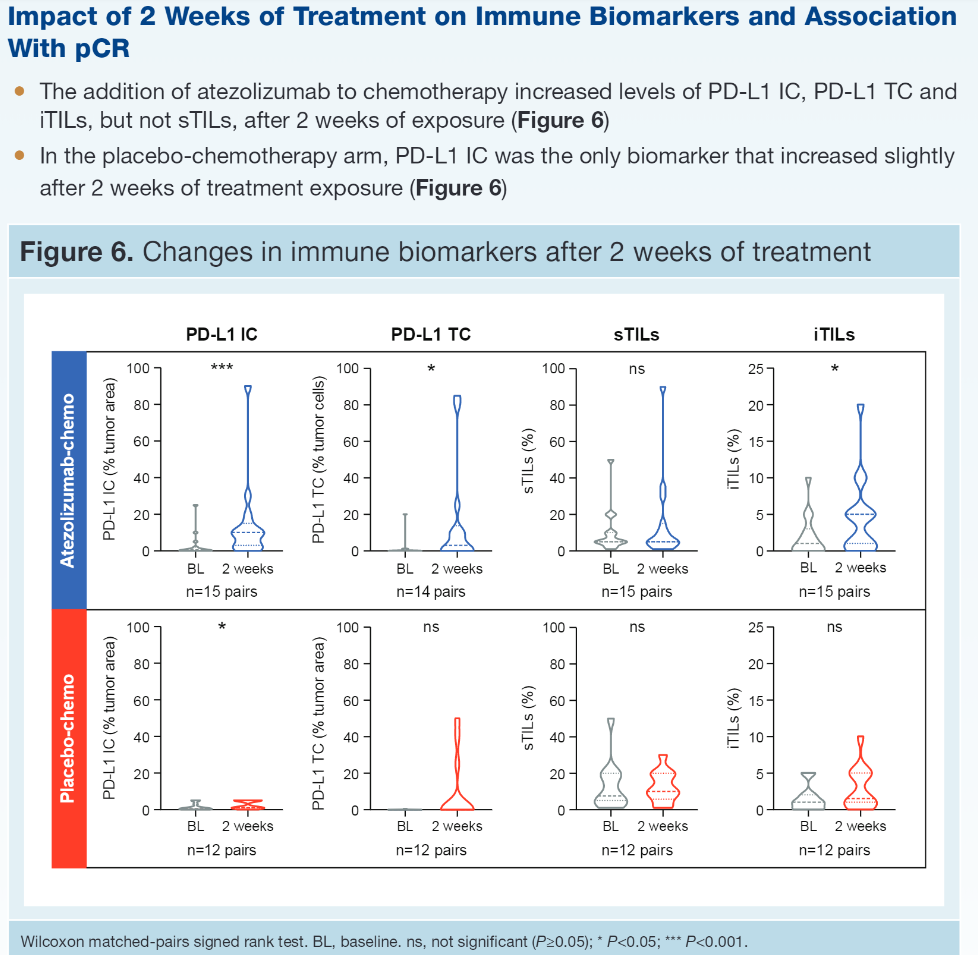

近年来被认为可以预测免疫治疗疗效的生物标志物中,研究最为深入的是PD-L1及肿瘤浸润淋巴细胞(TIL)。不同抗体检测出的PD-L1界值是不同的,IMpassion 031试验应用SP142,PD-L1阳性定义为肿瘤PD-L1浸润比例高于1%,而KEYNOTE 355试验采用CPS,取所有PD-L1浸润的细胞数(肿瘤细胞、淋巴细胞、巨噬细胞)除以全部肿瘤细胞数再乘以10,CPS≥1视为阳性。
KEYNOTE 522是第一个报道免疫治疗联合化疗获益与PD-L1状态无关的临床研究,在新辅助治疗中加入帕博利珠单抗后患者pCR率提高了13.6%,EFS提高了6% 。GeparNuevo 研究显示基线TIL水平不仅可以预测德瓦鲁单抗组的PCR率同样可以预测安慰剂组,而治疗中期TIL水平升高仅能预测德瓦鲁单抗组的pCR率。KEYNOTE 173试验中88%的患者在基线处及82%的患者在帕博利珠单抗治疗一周期后检测了TIL水平,达到pCR的患者治疗前及治疗中期的TIL中位水平较高,同时高TIL水平也与高pCR率相关。尽管TIL似乎可以预测pCR但既往的研究都不建议单用TIL,需要结合其他标志物如PD-L1水平,并设定合适的界值。IMpassion 031显示无论PD-L1状态如何,阿替利珠单抗联合白蛋白结合型紫杉醇续贯阿替利珠单抗+多柔比星+环磷酰胺的新辅助治疗方案可提高早期TNBC的pCR率。而达到pCR者有着怎样区别于未达到pCR者的免疫微环境呢,通过AACR本次呈现的结果初见端倪。
通过本次公布的结果我们似乎可以看到患者的自身免疫环境越好,对传统化疗方案的反应性越高;而如果想找到免疫调节点PD-L1抑制剂合适人群,的确还是应该在肿瘤细胞或免疫细胞PD-L1高表达者中,而且表达强度越高的人群pCR的可能性越大;免疫治疗可以激发某些早期TNBC的免疫调控能力即通俗上讲的冷肿瘤转变成热肿瘤,短时间窗口期生物标志物的动态变化对免疫治疗适应人群的预测能力也是未来需要研究的重要方向之一。
副主任医师 副教授 硕士研究生导师
医学博士 博士后
大连医科大学附属第二医院乳腺外科 副主任
中华医学会肿瘤学分会乳腺学组青委会委员
中国妇幼保健协会青委会委员
中国医药教育协会乳腺病专业委员会乳腺癌多学科诊疗学组委员
中国康复医学会修复重建外科专业委员会美容外科分会委员
JCO中文版青年编委
全球卫生部后备人才库
辽宁省细胞生物学学会乳腺肿瘤精准治疗与临床科研专业委员会副主任委员
辽宁省生命科学学会乳腺疾病微创诊断及治疗专业委员会青委会副主任委员
大连市“青年才俊”





 京公网安备 11010502033352号
京公网安备 11010502033352号