编者按:2020年12月5-8日,第62届美国血液学会(ASH)年会以线上形式召开,来自世界各地的血液学专家和学者齐聚ASH线上会议,众多重磅研究相继亮相。在多发性骨髓瘤(MM)领域,包括CAR-T在内的免疫治疗成为备受关注的焦点,其中美国哈佛大学Dana-Farber癌症研究院Nikhil munishi 教授有多项MM领域的研究入选本次ASH会议,为了更为深入了解MM领域的研究动态,《肿瘤瞭望》特邀采访了Nikhil Munshi 教授,针对高通量基因分析、CAR-T治疗等问题进行了深度解读,现将采访内容整理如下,以供读者参考。
《肿瘤瞭望》:高通量基因分析能为研究MM的发病机制和分子诊断提供新途径,本次ASH大会上您团队开展的一项研究探讨了高通量基因分析在低危冒烟型骨髓瘤中的应用,能否请您谈一谈?
#58.High Throughput Genomic Analysis Identifies Low-Risk Smoldering Multiple Myeloma
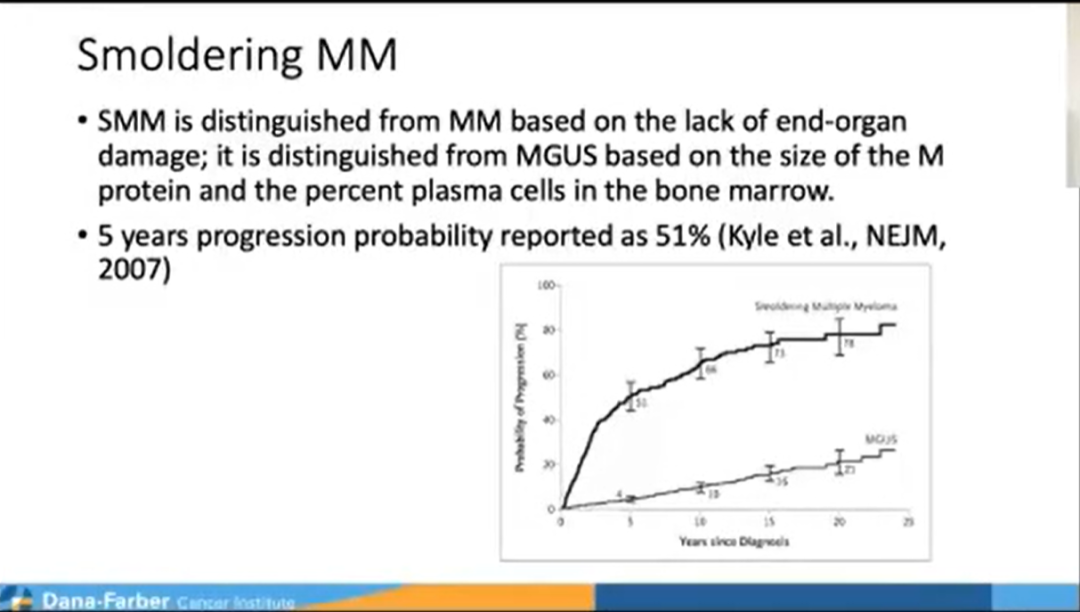
研究背景:多发性骨髓瘤之前有意义不明的单克隆丙种球蛋白病(MGUS)和冒烟型多发性骨髓瘤(SMM)的前体状态。研究表明,MGUS诊断后5年进展为症状性MM的比例为1%,SMM为10%。然而,基于基因组,该比率具有高度变异性,尤其是对于SMM患者。这一研究评估了SMM的高危基因组特征,但长期随访(≥5年)后未进展为MM的SMM患者的基因组背景尚未描述。
在这项研究中Munshi教授团队观察到非进展性SMM的基因组疤痕评分【GSS(中位数=3,IQR=[1-9])低于进展性MGUS/SMM(中位数=11,IQR=[5-15]/中位数=9,IQR=[9-15])以及诊断时的MM样本(中位数=9,IQR=[5-16],p=0.002)。】同时也观察到非进展者SMM对APOBEC和DNA修复突变过程的利用率显著较低。
Munshi教授:在该研究中,我们主要评估了高通量基因分析技术在低危冒烟型骨髓瘤(SMM)患者中的应用价值。在本研究纳入的患者中,部分SMM患者在5年以上均未进展为活动性多骨髓瘤,另有部分SMM患者进展至活动性骨髓瘤,而对于发生疾病进展的患者,我们在其进展之前留取了相对应的样本(即SMM或MGUS状态时的样本),当然也获取了其进展为活动性骨髓瘤时的样本。该研究采用高通量基因技术(包括全基因测序及RNA测序),旨在分析预测非进展组的相关因素。

研究显示,在编码区中可见显著的差异,若患者处于MGUS状态时,其基因突变数量要明显低于活动性多骨髓瘤或进展组患者,在未发生疾病进展的SMM患者中,NRAS和BRAF突变率均低至3%,并且未见到FAM46C、TTN及CYLD等驱动基因的突变,这是一项重要的发现,其基因突变差异也能帮助预测患者的生存结局。我们近期在临床肿瘤杂志(JCO)上发表的一项研究表明,非进展组SMM患者的基因组疤痕评分(GSS)要低于进展组患者,因此GSS能预测SMM发生进展的可能性。

此外,我们也进行了其它的基因测序,致力于发现其它可预测SMM患者生存结局的基因突变模式,我们发现,进展组患者已经获得了与侵袭性相关的某些特征,例如富含MYC靶基因、DNA修复基因或mTOR信号通路的激活,这更多地意味着患者具有进展特征,在此部分患者中,APOBEC等基因突变的具体特征也具有重要的意义。
综上,本摘要表明,5年以上未进展的SMM患者与进展组患者存在显著的差异,基因突变模式、突变特征、基因表达谱及信号通路激活等方面的差异能帮助鉴别两组患者,该研究首次采用基于基因组学的方法来区分出低危SMM患者,而剩余的患者可视为高危型SMM患者。
《肿瘤瞭望》:本次ASH大会上,您团队的一项研究针对多发性骨髓瘤的维奈克拉耐药机制进行了探索,能否请您结合研究谈一谈?
#2272 .Activation of the ERK Pathway Drives Acquired Resistance to Venetoclax in MM Cell Models
研究背景:多发性骨髓瘤(MM)是一种血液系统恶性肿瘤,其特征为各种基因异常包括14q32处涉及IgH基因的易位。其中,t(11;14)是最常见的易位之一。最近的临床数据表明,BCL2的小分子抑制剂Venetoclax在该MM患者亚组中具有显著影响本研究旨在阐明其作用机制的广泛研究。
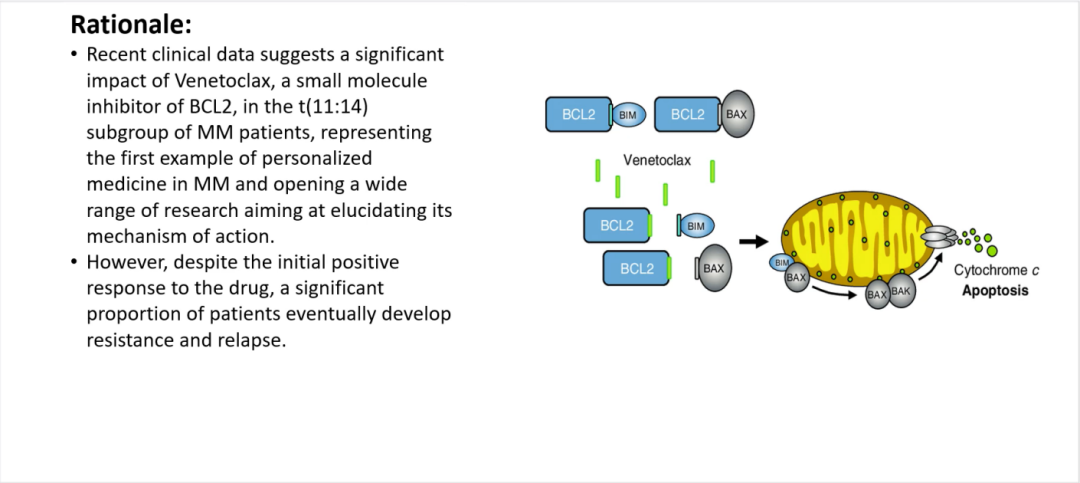
Munshi教授:维奈克拉是一类靶向于BCL-2的重要药物,目前已被批准用于淋巴系统恶性肿瘤的治疗。但是,我们经过评估发现维奈克拉对于多发性骨髓瘤(MM)也有疗效,尤其是与硼替佐米联合应用时。维奈克拉对于t(11;14)、CyclinD1及BCL-2上调的MM患者有效,能用于此类患者的治疗。然而,MM患者在经维奈克拉治疗后仍可能复发,因此我们开始致力于研究与维奈克拉耐药相关的生物标志。
在该研究中,我们首先探索了维奈克拉的外在耐药性,应用维奈克拉治疗两种细胞系并诱导耐药发生,随后发现维奈克拉的耐药过程更倾向于多样化,在发生耐药的细胞克隆中,我们可观测到多种信号通路的激活,ERK抑制剂能对维奈克拉耐药细胞克隆带来额外的杀伤力,随后我们试图将维奈克拉耐药与内在的信号通路进行关联。我们发现,具有内在耐药性的细胞系与外在耐药信号通路的模式并不相同,其ERK信号通路的激活并不十分显著。
众所周知,MCL-1及BCL-XL基因表达变化及相互比例增高是MM发病的驱动因素,这在MM及其他恶性肿瘤中均进行了探讨。研究发现GOS2基因下调对于内在耐药性极为重要,我们应进一步理解及探索GOS2基因的作用。在该摘要中,我们证明ERK信号通路的激活是维奈克拉耐药的主要分子学机制之一,因此开始采用其他药物与维奈克拉联合治疗,例如ERK抑制剂,MCL-1靶向药也可与维奈克拉联合产生协同作用。
《肿瘤瞭望》:BCMA CAR-T是当前复发或难治多发性骨髓瘤的研究热点,为患者带来了非常高的缓解率,能否结合您团队的研究谈一谈BCMA CAR-T的研究进展?
#130.Updated Results from the Phase I CRB-402 Study of Anti-Bcma CAR-T Cell Therapy bb21217 in Patients with Relapsed and Refractory Multiple Myeloma: Correlation of Expansion and Duration of Response with T Cell Phenotypes
#131.Idecabtagene Vicleucel (ide-cel, bb2121), a BCMA-Directed CAR T Cell Therapy, in Patients with Relapsed and Refractory Multiple Myeloma: Updated Results from Phase 1 CRB-401 Study
#134.Phase 1/2 Study of the Safety and Response of P-BCMA-101 CAR-T Cells in Patients withRelapsed/Refractory (r/r) Multiple Myeloma (MM) (PRIME) with Novel Therapeutic Strategies
研究背景:BCMA靶点是继CD19后又一极具潜力的治疗通路,今年ASH上诸多关于这一靶点的转化成果亮相,包括#130、131、134在内的多个研究都汇报了关于BCMA在骨髓瘤中的治疗效果,并具有高效低毒的特性值得后续进一步开展扩展队列。
Munshi教授:BCMA CAR-T细胞治疗是令人兴奋的,在ASH大会上,有多种来自于美国、欧洲及中国的BCMA CAR-T产品。在 KarMMa、Legend等大型研究中阐述了BCMA CAR-T的作用机制,所有研究中的疗效数据几乎相似,总体缓解率可达75%~95%,毒副作用较为有限。主要的毒副作用包括淋巴细胞衰减导致的血细胞减少,细胞因子释放综合征(CRS)几乎发生于所有CAR-T治疗的患者中,但严重程度一般较低(1级或2级),3级CRS较为罕见(5%~7%)。
非常重要的是,不同于淋巴瘤的CAR-T治疗,BCMA CAR-T治疗骨髓瘤时的神经毒性并不常见。但CAR-T治疗的担忧点仍主要为无进展生存(PFS),即使缓解率非常高,且获得了深度缓解(一半患者达到CR或MRD阴性的PR),其PFS却依然仅为8~12个月,患者仍然会出现复发。令人兴奋的是,MM患者即便在非常晚期的阶段应用CAR-T治疗(通常5~6线治疗),但也能获得很好的缓解率。目前CAR-T治疗的主要致力方向在于如何提升PFS,很多措施正在计划或应用于临床,例如,将CAR-T用于二线治疗或在部分高危患者中用于一线治疗,此外采用维持治疗也是提升PFS的策略之一。
另有部分研究,在一段时间内同时应用两种CAR-T细胞输注治疗或者联合免疫调节剂(IMiDs)。CAR-T的疗效令人兴奋,正在应用于疾病的更早期阶段,我们期待在不久的将来有更多的临床数据公布。
《肿瘤瞭望》:除外CAR-T治疗,能否请您结合相关研究谈一谈RRMM治疗的其他进展
#290.A Phase 1, First-in-Human Study of Talquetamab, a G Protein-Coupled Receptor Family C Group 5 Member D (GPRC5D) x CD3 Bispecific Antibody, in Patients with Relapsed and/or Refractory Multiple Myeloma (RRMM)
#666.Mechanisms of Resistance and Determinants of Response of the GPRC5D-Targeting T-Cell Redirecting Bispecific Antibody JNJ-7564 in Multiple Myeloma
研究背景:尽管随着MM治疗药物的开发,患者的平均生存时间大幅度延长,但大多数患者最终会进展、复发。这就需要新型治疗方法出现。GPRC5D是一种孤儿受体,其转录本在原代MM细胞中高表达,但在其他地方的表达普遍有限,使其成为一个有吸引力的治疗靶点。
Munshi教授:总体而言,免疫治疗是本次ASH大会上迄今为止最受关注的焦点。免疫治疗的形式是多样的,不仅仅包括我上述提到的CAR-T治疗。
免疫治疗可针对于不同的靶点,具有不同的作用机制,包括双特异性分子等,我们需牢记所有这些新的治疗方法。例如,BCMA是一个复发/难治多发性骨髓瘤(RRMM)中非常重要的靶点,除此之外,还有其他两种靶点正在研究中。其中一个靶点是GPRC5D,这是非常令人兴奋的靶点,因为它主要表达于骨髓瘤细胞上。
在早期研究中,采用双特异性抗体CAR-T治疗RRMM,获得了非常好的缓解率且毒副作用较低,因此GPRC5D是CAR-T治疗的重要新靶点,且可作为双特异性CAR-T。另外一个重要的CAR-T靶点是FCRL5,主要表达于骨髓瘤细胞中的1号染色体长臂(1q)或特定亚型。在早期双特异性研究中,靶向FCRL5的CAR-T显示了良好的疗效。因此在BCMA之外有两种新的免疫治疗靶点,采用双特异性抗体连接BCMA 及新靶点的CAR-T可获得非常好的疗效,双特异性CAR-T具有非常不俗的疗效和可靠的耐受性,毒副作用较低。因此,我认为本次ASH大会上,免疫治疗进展极为重要,CAR-T治疗则首当其冲,BCMA联合其他新靶点的双特异性CAR-T为RRMM患者带来了持久且深层次缓解。
总而言之,免疫治疗是本次ASH大会上MM领域中最重要的进展,基于抗体的治疗将在未来非常有意义及价值。
丹娜法伯癌症研究所
哈佛医学院医学教授
Munshi博士于1984年获得印度Maharaja Sayjirao大学的医学博士学位。他在SSG医院和Maharaja Sayjirao大学完成了内部医学的研究生培训,随后在Johns Hopkins肿瘤学中心和印第安纳大学医学中心获得了研究金。他于2001年加入丹娜法伯癌症研究所,现任杰罗姆·利珀·多发性骨髓瘤中心基础和相关科学主任。





 京公网安备 11010502033352号
京公网安备 11010502033352号