编者按:免疫治疗为“最恶”的三阴性乳腺癌(TNBC)患者带来了新的希望,在各大肿瘤国际会议上,免疫治疗的研究进展总是以“C位”出场,吸睛众多。阿替利珠单抗的3期临床试验IMpassion 130在今年ESMO公布了最终的OS分析结果,并在近日的ESMO Asia乳腺癌口头报告中,也进行了OS最终结果及其他细节数据的披露。本期“瞭望FM”栏目中,哈尔滨医科大学附属肿瘤医院的张清媛教授将带领我们复盘IMpassion 130研究的历次数据分析;并讨论国内外三阴性乳腺癌免疫治疗的最新进展。
众所周知,基于IMpassion 130研究结果,美国FDA已经批准阿替利珠单抗联合白蛋白结合型紫杉醇治疗PD-L1阳性的局部晚期或转移性三阴性乳腺癌(TNBC)患者。同时,各大国际指南也均对这一方案进行了推荐,改变了晚期TNBC的治疗格局。
IMpassion 130研究是一项评价阿替利珠单抗+白蛋白紫杉醇治疗晚期三阴性乳腺癌(TNBC)的关键3期研究,已经过数次数据分析,并在近两年的各大国际肿瘤学会议上报道而备受瞩目。在最近的2020年ESMO大会上,研究者报告了最终的OS和长期安全性分析,阿替利珠单抗+白蛋白紫杉醇最终将PD-L1阳性晚期TNBC患者的中位OS延长7.5个月。在刚刚举行的2020年ESMO Asia大会上也对该研究的最终结果及其他细节数据进行披露。
下面我跟大家回顾一下IMpassion 130研究:
该研究是一项随机、双盲、安慰剂对照的Ⅲ期临床试验。研究共计入组902例患者,按照1:1随机分组,分别接受阿替利珠单抗+白蛋白结合型紫杉醇或安慰剂+白蛋白结合型紫杉醇治疗,直至疾病进展或毒性无法耐受。主要研究终点为ITT人群和PD-L1阳性人群的PFS,首次期中分析ITT人群和PD-L1阳性人群的OS。
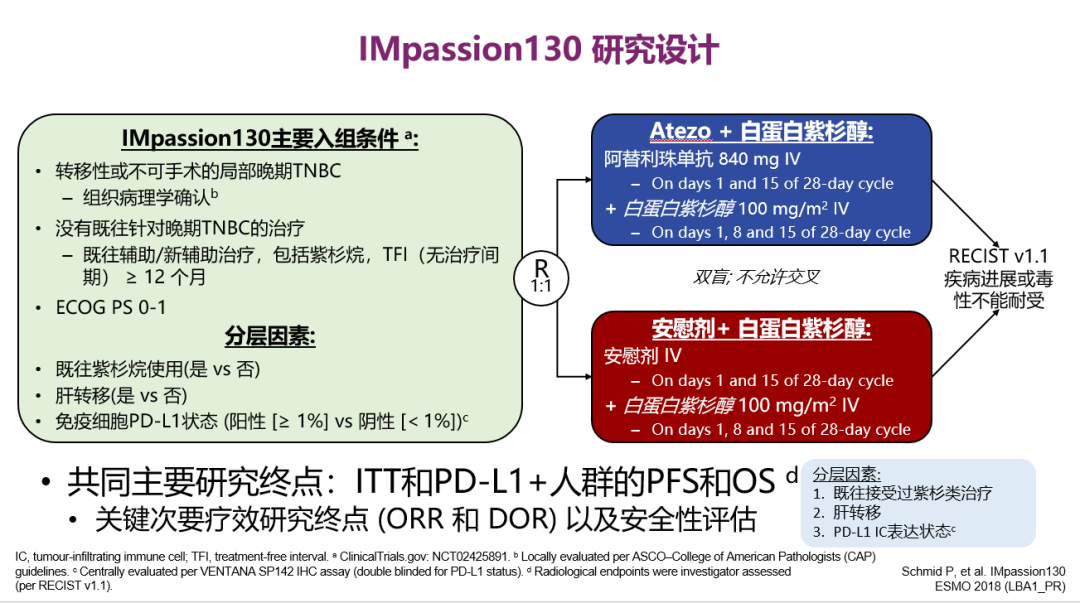 IMpassion 130研究设计
IMpassion 130研究设计
2018年,NEJM发布IMpassion 130研究的最终PFS分析结果。主要研究终点:ITT人群中两组中位PFS分别为7.2个月和5.5个月(HR 0.80;95%CI:0.69~0.92;P=0.0025)。PD-L1阳性人群中两组中位PFS分别为7.5个月和5.0个月(HR 0.62;95%CI:0.49~0.78;P<0.0001)。
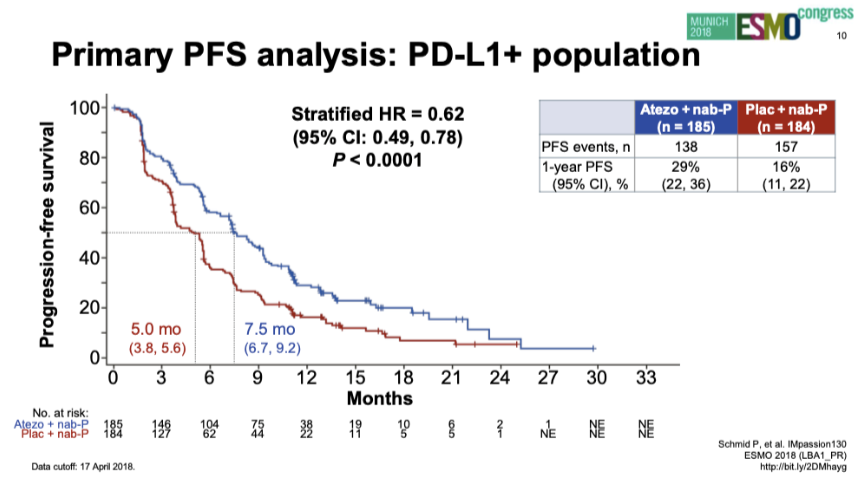 PD-L1阳性人群PFS(2018年ESMO)
PD-L1阳性人群PFS(2018年ESMO)
2018年ESMO报道ITT人群中期OS分析:两组中位OS分别为21.3个月和17.6个月(HR 0.84;95%CI:0.69~1.02;P=0.084)。
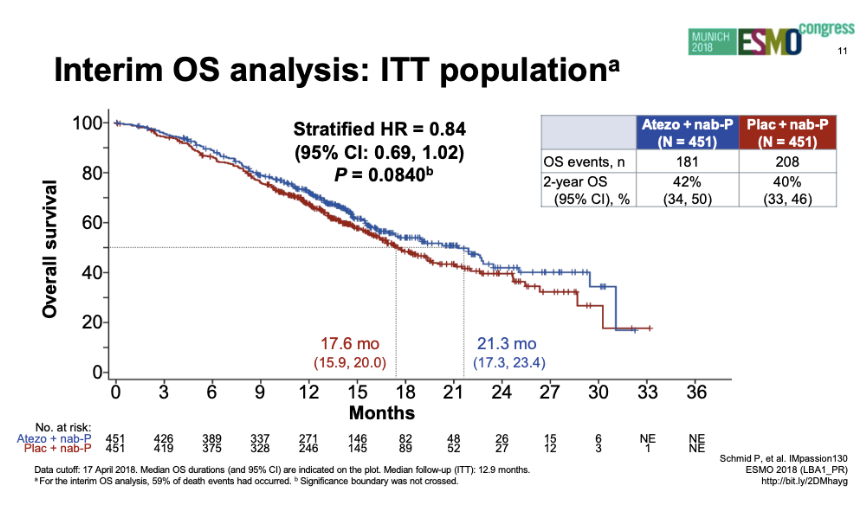 ITT人群OS(2018年ESMO)
ITT人群OS(2018年ESMO)
2018年ESMO报道PD-L1阳性人群中期OS分析:两组中位OS分别为25.0个月和15.5个月(HR 0.62;95%CI:0.45~0.86)。
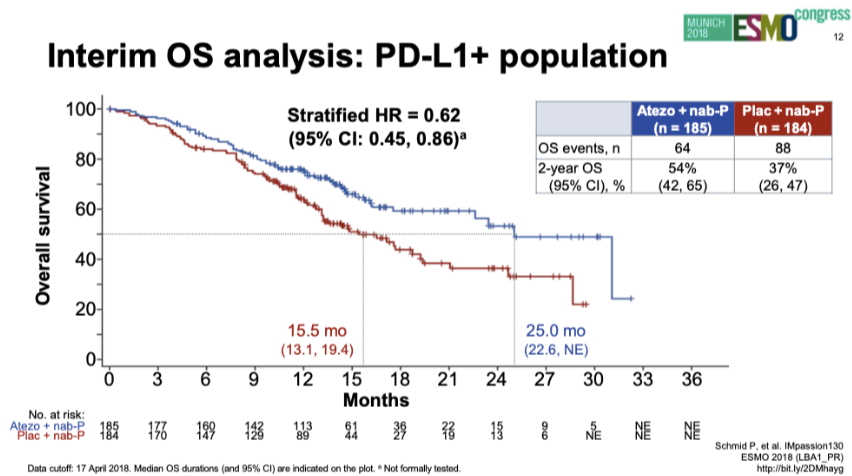 PD-L1阳性人群OS(2018年ESMO)
PD-L1阳性人群OS(2018年ESMO)
?
2019年ASCO报道ITT人群OS分析:两组中位OS分别为21.0个月和18.7个月(HR 0.86;95%CI:0.72~1.02;P=0.0777)。
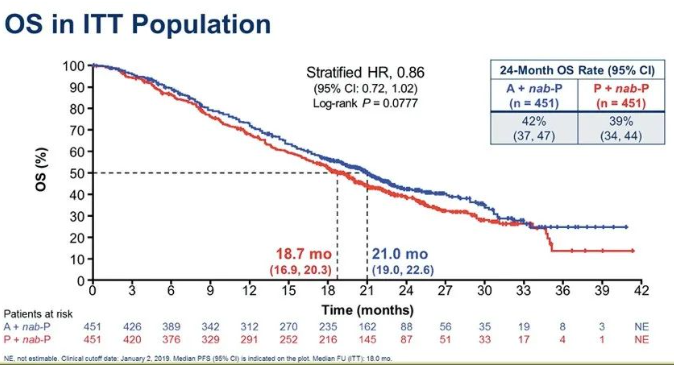 ITT人群OS(2019年ASCO)
ITT人群OS(2019年ASCO)
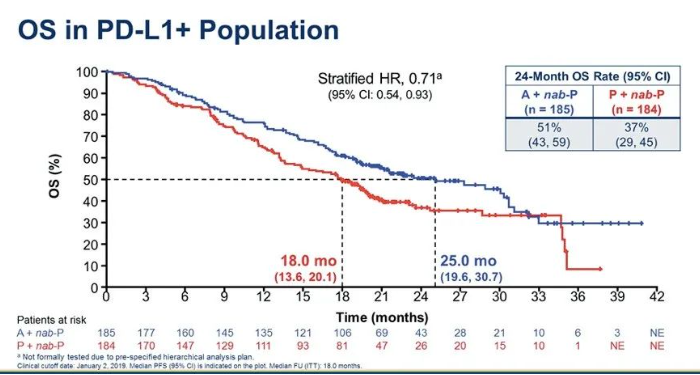
2019年ASCO报道PD-L1阳性人群OS分析:两组中位OS分别为25.0个月和18.0个月(HR 0.71;95%CI:0.54~0.93)。经过更长时间的随访,阿替利珠单抗组OS仍然超过2年。
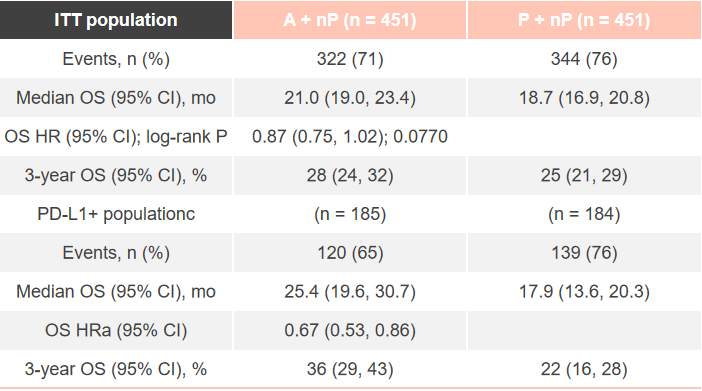
在今年ESMO大会上,报告了最终OS数据,截至2020年4月14日,73.8%的患者已经死亡。中位OS的随访时间是18.8个月。ITT人群两组患者的中位OS分别为21.0个月和18.7个月(HR 0.87;95%CI:0.75~1.02;P=0.0770);3年OS率分别为28%和25%。在PD-L1阳性人群中,两组中位OS分别为25.4个月和17.9个月(HR 0.67;95%CI:0.53~0.86);3年OS率分别为36%和22%。
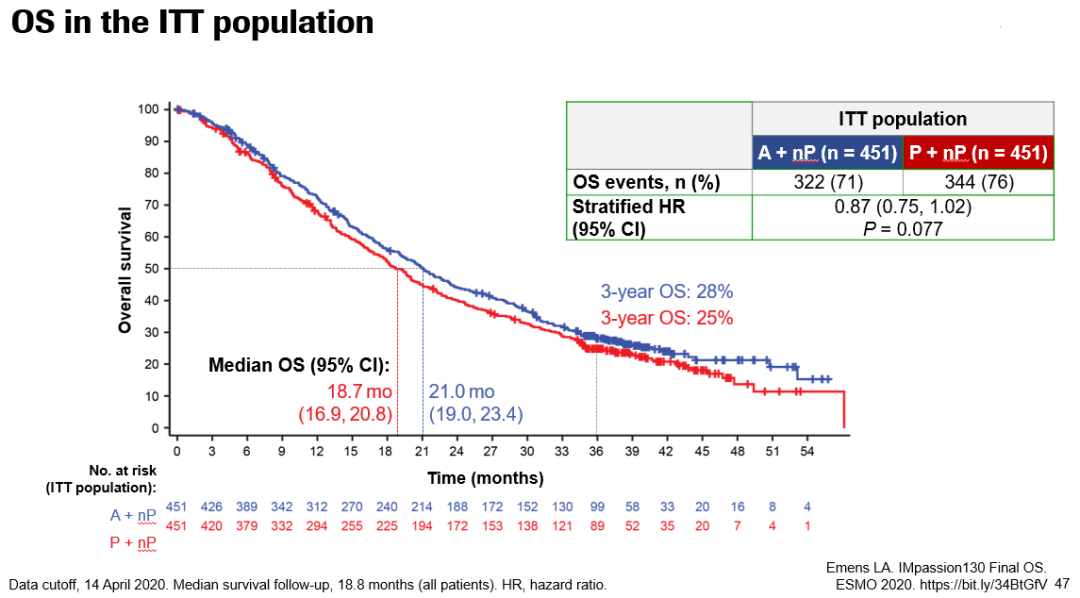
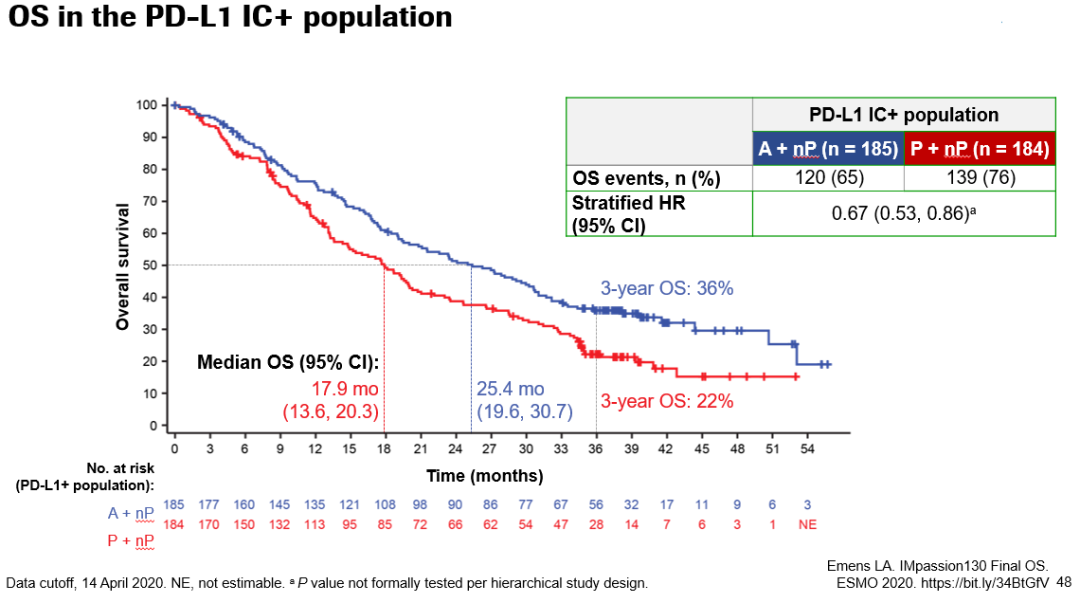
2020年ESMO Asia大会也将补充2组最终的事件数,阿替利珠单抗组发生事件322次,对照组发生时间数344次,其他结果同上次ESMO会议。
今年ESMO会议发布的安全性分析:研究显示阿替利珠单抗+白蛋白结合型紫杉醇的联合应用具有良好的耐受性,并没有新发现的不良反应,且大部分免疫相关不良反应都可缓解,2020年ESMO报道的最终分析显示安全性并未发现更多5级不良反应的发生。
总体来说,本次结果更新显示,中位随访时间达到18.8个月时,在总人群中免疫联合组延长了中位OS(21 vs 18.7个月,HR 0.87,P=0.0770),展现出生存获益的趋势。在PD-L1表达阳性的亚组,阿替利珠单抗组将中位OS延长了7.5个月(25.4 vs 17.9个月),降低了33%死亡风险(HR=0.67),并将3年生存率提高了14%(36% vs 22%)。这意味着,使用阿替利珠单抗+白蛋白紫杉醇的晚期TNBC患者,超过三分之一可以活过3年,对于TNBC而言是个重大突破。
安全性方面,两组患者的不良反应发生率分别为51%和43%,严重不良反应发生率分别为24%和19%,两组中分别有18%和8%的不良反应导致白蛋白结合型紫杉醇治疗中断,8%和1%的不良反应导致阿替利珠单抗或安慰剂治疗中断。总体不良反应是可控的。
IMpassion130研究没有纳入中国的患者,考虑到种族方面的差异,阿替利珠单抗联合化疗在中国的临床应用需要参照中国的临床试验。此前中国参与的IMpassion131试验,治疗方案为阿替利珠单抗联合紫杉醇,其余设计因素与IMpassion130研究相似,该研究没有达到首要研究终点:即在紫杉醇中加入阿替利珠单抗没有显著延长PD-L1+转移性TNBC患者的PFS;也没有证据显示在紫杉醇治疗中加入阿替利珠单抗会有OS的获益(次要研究终点)。
与获益的IMpassion130( 阿替利珠+白蛋白紫杉醇)研究对比,IMpassion131研究失败的潜在原因需要进一步探索。另外,国内即将开展的IMpassion132研究,将探索在晚期三阴性乳腺癌一线治疗中,阿替利珠单抗联合卡铂或其他化疗药物的疗效,我们拭目以待。
另外,在免疫治疗领域,其他PD-1类药物也在进行积极的探索和研究,如KEYNOTE-355研究是一项评估帕博利珠单抗+化疗一线治疗局晚或晚期的TNBC随机、双盲的Ⅲ期研究。2020年ASCO大会报道结果显示,在CPS≥10的患者中,帕博利珠单抗+化疗取得了PFS的显著改善(9.7 vs 5.6个月)。本次ESMO Asia大会进一步报道亚洲人群的数据。截至2019年12月11日,纳入来自中国香港、中国台湾、日本、韩国、马来西亚的患者160例(帕博利珠单抗组113例)。中位随访时间为25.7个月。在ITT人群中,帕博利珠单抗+化疗可改善PFS(8.8 vs 6.7个月);随着PD-L1表达水平的增加,治疗效果提高。
综上可见,免疫治疗在三阴性乳腺癌领域正成为炙手可热的研究方向,我们期待未来能有更多的数据出现,以指导三阴性乳腺癌的综合治疗,进一步改善患者的远期预后,构筑三阴性乳腺癌治疗新的里程碑。
主任医师、二级教授、博士生导师、省教学名师
黑龙江省肿瘤防治研究所所长
哈尔滨医科大学附属肿瘤医院副院长
肿瘤学国家重点专科带头人
国家百千万人才工程入选者
国家突出贡献中青年专家
中国抗癌协会淋巴瘤专业委员会候任主任委员
中国抗癌协会化疗专业委员会副主任委员
中国抗癌协会乳腺癌专业委员会常委
中国临床肿瘤学会(CSCO)乳腺癌专家委员会副主任委员





 京公网安备 11010502033352号
京公网安备 11010502033352号